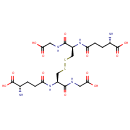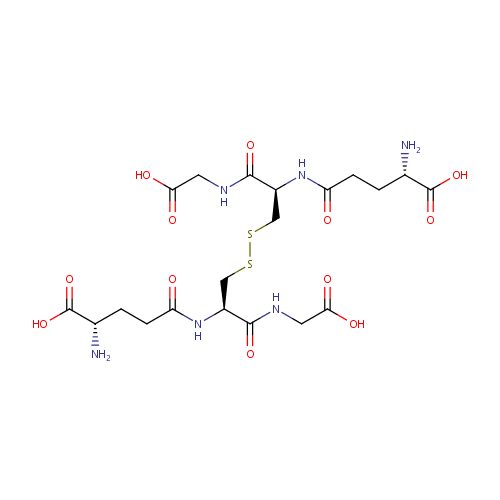
Glutathione disulfide (PAMDB001629)
| Record Information | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 1.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Update Date | 1/22/2018 11:54:54 AM | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolite ID | PAMDB001629 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name: | Glutathione disulfide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description: | Glutathione (GSH) is a tripeptide with a gamma peptide linkage between the amine group of cysteine (which is attached by normal peptide linkage to a glycine) and the carboxyl group of the glutamate side-chain. It is an antioxidant, preventing damage to important cellular components caused by reactive oxygen species such as free radicals and peroxides. Glutathione is a cofactor for the enzyme glutathione peroxidase. Glutathione is also needed for the detoxification of methylglyoxal, a toxin produced as a by-product of metabolism. This detoxification reaction is carried out by the glyoxalase system. Glyoxalase (EC 4.4.1.5) catalyzes the conversion of methylglyoxal and reduced glutathione to S-D-Lactoyl-glutathione. Glyoxalase (EC 3.1.2.6) catalyzes the hydrolysis of S-D-Lactoyl-glutathione to glutathione and D-lactate.; Glutathione disulfide (GSSG) is a disulfide derived from two glutathione molecules. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Formula: | C20H32N6O12S2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Average Molecular Weight: | 612.631 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Molecular Weight: | 612.151961898 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Key: | YPZRWBKMTBYPTK-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI: | InChI=1S/C20H32N6O12S2/c21-9(19(35)36)1-3-13(27)25-11(17(33)23-5-15(29)30)7-39-40-8-12(18(34)24-6-16(31)32)26-14(28)4-2-10(22)20(37)38/h9-12H,1-8,21-22H2,(H,23,33)(H,24,34)(H,25,27)(H,26,28)(H,29,30)(H,31,32)(H,35,36)(H,37,38) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS number: | 27025-41-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IUPAC Name: | (2S)-2-amino-4-{[(1R)-2-{[(2R)-2-[(4S)-4-amino-4-carboxybutanamido]-2-[(carboxymethyl)carbamoyl]ethyl]disulfanyl}-1-[(carboxymethyl)carbamoyl]ethyl]carbamoyl}butanoic acid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Traditional IUPAC Name: | glutathione disulfide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES: | NC(CCC(=O)NC(CSSCC(NC(=O)CCC(N)C(O)=O)C(=O)NCC(O)=O)C(=O)NCC(O)=O)C(O)=O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Taxonomy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taxonomy Description | This compound belongs to the class of organic compounds known as gamma-glutamyl peptides. These are oligo- and polypeptides consisting of any C-terminal alpha peptide having a gamma-glutamyl residue attached at the N alpha-position. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Organic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Super Class | Organic acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Class | Carboxylic acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Amino acids, peptides, and analogues | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Gamma-glutamyl peptides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alternative Parents | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substituents |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Aliphatic acyclic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| State: | Solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Charge: | -2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point: | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Experimental Properties: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cellular Locations: | Cytoplasm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reactions: | glutaredoxin + 2 Glutathione > glutaredoxin + Glutathione disulfide Arsenate + 2 Glutathione > Arsenite + Glutathione disulfide + Water periplasmic disulfide isomerase/thiol-disulphide oxidase (oxidized) + 2 Glutathione > periplasmic disulfide isomerase/thiol-disulphide oxidase (reduced) + Glutathione disulfide 2 Glutathione + Hydrogen peroxide <> Glutathione disulfide +2 Water protein disulfide isomerase II (oxidized) + 2 Glutathione > protein disulfide isomerase II (reduced) + Glutathione disulfide 2 Glutathione + NAD <> Glutathione disulfide + NADH + Hydrogen ion 2 Glutathione + NADP <> Glutathione disulfide + NADPH + Hydrogen ion Selenite + Glutathione + Hydrogen ion > Selenodiglutathione + Glutathione disulfide + Water 2-hydroxyethyldisulfide + Glutathione 2-mercaptoethanol + Glutathione disulfide 2 Glutathione + NADP > Glutathione disulfide + NADPH Oxidized glutathione + Hydrogen ion + NADPH + Glutathione disulfide + NADPH > NADP +2 Glutathione | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pathways: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| References | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| References: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synthesis Reference: | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Material Safety Data Sheet (MSDS) | Download (PDF) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Links | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Links: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Enzymes
- General function:
- Involved in oxidoreductase activity
- Specific function:
- Maintains high levels of reduced glutathione in the cytosol
- Gene Name:
- gor
- Locus Tag:
- PA2025
- Molecular weight:
- 49.2 kDa
Reactions
| 2 glutathione + NADP(+) = glutathione disulfide + NADPH. |
- General function:
- Involved in arsenate reductase (glutaredoxin) activity
- Specific function:
- Reduction of arsenate [As(V)] to arsenite [As(III)]. This protein expands the substrate specificity of ArsAB pump which can extrude arsenite and antimonite to allow for arsenate pumping and resistance
- Gene Name:
- arsC
- Locus Tag:
- PA2279
- Molecular weight:
- 16.6 kDa
Reactions
| Arsenate + glutaredoxin = arsenite + glutaredoxin disulfide + H(2)O. |
- General function:
- Posttranslational modification, protein turnover, chaperones
- Specific function:
- Involved in disulfide bond formation. DsbG and DsbC are part of a periplasmic reducing system that controls the level of cysteine sulfenylation, and provides reducing equivalents to rescue oxidatively damaged secreted proteins such as ErfK, YbiS and YnhG. Probably also functions as a disulfide isomerase with a narrower substrate specificity than DsbC. DsbG is maintained in a reduced state by DsbD. Displays chaperone activity in both redox states in vitro
- Gene Name:
- dsbG
- Locus Tag:
- PA2476
- Molecular weight:
- 28.1 kDa
- General function:
- Involved in electron carrier activity
- Specific function:
- Monothiol glutaredoxin involved in the biogenesis of iron-sulfur clusters (Probable)
- Gene Name:
- grxD
- Locus Tag:
- PA3533
- Molecular weight:
- 11.8 kDa
- General function:
- Involved in cell redox homeostasis
- Specific function:
- Acts as a disulfide isomerase, interacting with incorrectly folded proteins to correct non-native disulfide bonds. DsbG and DsbC are part of a periplasmic reducing system that controls the level of cysteine sulfenylation, and provides reducing equivalents to rescue oxidatively damaged secreted proteins. Acts by transferring its disulfide bond to other proteins and is reduced in the process. DsbC is reoxidized by DsbD
- Gene Name:
- dsbC
- Locus Tag:
- PA3737
- Molecular weight:
- 26.1 kDa
- General function:
- Involved in electron carrier activity
- Specific function:
- The disulfide bond functions as an electron carrier in the glutathione-dependent synthesis of deoxyribonucleotides by the enzyme ribonucleotide reductase. In addition, it is also involved in reducing some disulfides in a coupled system with glutathione reductase
- Gene Name:
- grxC
- Locus Tag:
- PA5129
- Molecular weight:
- 9.2 kDa