D-Lactic acid (PAMDB000334)
| Record Information | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 1.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Update Date | 1/22/2018 11:54:54 AM | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolite ID | PAMDB000334 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name: | D-Lactic acid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description: | D-Lactic acid is the end product of the enzyme Glyoxalase ([EC:3.1.2.6] hydroxyacyl-glutathione hydrolase) which converts the intermediate substrate S-lactoyl-glutathione to reduced glutathione and D-lactate. (OMIM 138790) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
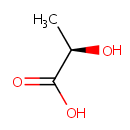
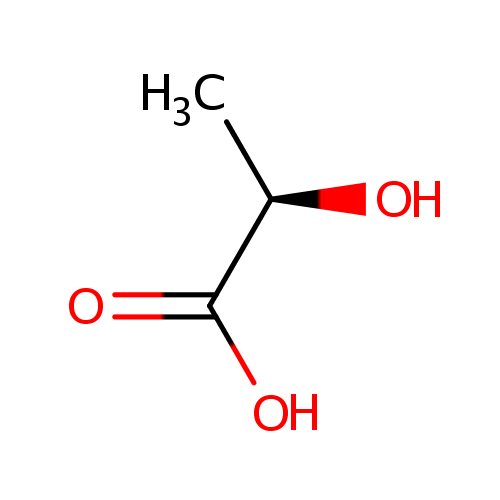
| Structure | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Formula: | C3H6O3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Average Molecular Weight: | 90.0779 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Molecular Weight: | 90.031694058 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Key: | JVTAAEKCZFNVCJ-UWTATZPHSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI: | InChI=1S/C3H6O3/c1-2(4)3(5)6/h2,4H,1H3,(H,5,6)/t2-/m1/s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS number: | 10326-41-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IUPAC Name: | (2R)-2-hydroxypropanoic acid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Traditional IUPAC Name: | D-lactic acid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES: | C[C@@H](O)C(O)=O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Taxonomy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taxonomy Description | This compound belongs to the class of organic compounds known as alpha hydroxy acids and derivatives. These are organic compounds containing a carboxylic acid substituted with a hydroxyl group on the adjacent carbon. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Organic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Super Class | Organic acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Class | Hydroxy acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Alpha hydroxy acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Alpha hydroxy acids and derivatives | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alternative Parents | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Substituents |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Aliphatic acyclic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| State: | Solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Charge: | -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point: | 52.8 C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Experimental Properties: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological Properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cellular Locations: | Cytoplasm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reactions: | D-Lactic acid + NAD <> Hydrogen ion + NADH + Pyruvic acid Water + S-Lactoylglutathione > Glutathione + Hydrogen ion + D-Lactic acid D-Lactic acid + Ubiquinone-8 > Pyruvic acid + Ubiquinol-8 S-Lactoylglutathione + Water <> Glutathione + D-Lactic acid an electron-transfer-related quinone + D-Lactic acid > an electron-transfer-related quinol + Pyruvic acid D-Lactic acid + Hydrogen ion < Pyruvaldehyde + Water N-Acetylmuramic acid 6-phosphate + Water <> N-Acetyl-D-Glucosamine 6-Phosphate + D-Lactic acid D-Lactic acid + NAD > Pyruvic acid + NADH D-Lactic acid > Pyruvaldehyde + Water MurNAc-6-P + Water > D-Lactic acid + N-Acetylglucosamine 6-phosphate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pathways: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| References | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| References: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synthesis Reference: | Hsieh, Chun Lung; Houng, Jer Yiing. Preparation of D-lactic acid from D,L-lactic acid ester using wheat germ or pancreatic lipase. U.S. (1997), 5 pp. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Material Safety Data Sheet (MSDS) | Download (PDF) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Links | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| External Links: |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Enzymes
- General function:
- Involved in oxidoreductase activity, acting on the CH-OH group of donors, NAD or NADP as acceptor
- Specific function:
- Fermentative lactate dehydrogenase
- Gene Name:
- ldhA
- Locus Tag:
- PA0927
- Molecular weight:
- 35.8 kDa
Reactions
| (R)-lactate + NAD(+) = pyruvate + NADH. |
- General function:
- Not Available
- Specific function:
- Functions as a holding molecular chaperone (holdase) which stabilizes unfolding intermediates and rapidly releases them in an active form once stress has abated. Plays an important role in protecting cells from severe heat shock and starvation, as well as in acid resistance of stationary-phase cells. It uses temperature-induced exposure of structured hydrophobic domains to capture and stabilizes early unfolding and denatured protein intermediates under severe thermal stress. Catalyzes the conversion of methylglyoxal (MG) to D-lactate in a single glutathione (GSH)-independent step. It can also use phenylglyoxal as substrate. Glyoxalase activity protects cells against dicarbonyl stress. Displays an aminopeptidase activity that is specific against peptide substrates with alanine or basic amino acids (lysine, arginine) at N-terminus. Functions as a holding molecular chaperone (holdase) which stabilizes unfolding intermediates and rapidly releases them in an active form once stress has abated. Plays an important role in protecting cells from severe heat shock and starvation, as well as in acid resistance of stationary-phase cells. It uses temperature-induced exposure of structured hydrophobic domains to capture and stabilizes early unfolding and denatured protein intermediates under severe thermal stress. Catalyzes the conversion of methylglyoxal (MG) to D-lactate in a single glutathione (GSH)-independent step. It can also use phenylglyoxal as substrate. Glyoxalase activity protects cells against dicarbonyl stress. Displays an aminopeptidase activity that is specific against peptide substrates with alanine or basic amino acids (lysine, arginine) at N-terminus.
- Gene Name:
- hchA
- Locus Tag:
- PA1135
- Molecular weight:
- 31.9 kDa
Reactions
| (R)-lactate = methylglyoxal + H(2)O. |
| (R)-lactate = methylglyoxal + H(2)O. |
Transporters
- General function:
- Involved in lactate transmembrane transporter activity
- Specific function:
- Transports L-lactate across the membrane. Can also transport D-lactate and glycolate. Seems to be driven by a proton motive force
- Gene Name:
- lldP
- Locus Tag:
- PA4770
- Molecular weight:
- 58.7 kDa